LABORATORIO DE GASES
a continuación nos centraremos en el tema fundamental de química Gases;para esto realizaremos un laboratorio bastante interesante,donde podrás observar,practicar,conocer diversas aplicaciones,conceptos,leyes,etc los cuales te servirán para practicar diversos ejercicios correctamente.
OBJETIVOS
- Conocer y diferenciar las formulas de cada Ley
- Reforzar los conocimientos previos acerca de estas Leyes
- Conocer las propiedades de los gases
- Conocer y diferenciar los diversos conceptos de gases
- Utilizar correctamente la calculadora y reconocer sus respectivas funciones
MARCO TEÓRICO
Todo acerca de gases,su concepto,propiedades y demás
- Se denomina gas al estado de agregación a la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética. Los gases son fluidos altamente compresible, que experimentan grandes cambios de densidad con la presión y la temperatura.

- Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
otros datos importantes acerca de los gases :
- A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa
PANTALLASOS DE CONCEPTOS IMPORTANTES
estados de agregación:


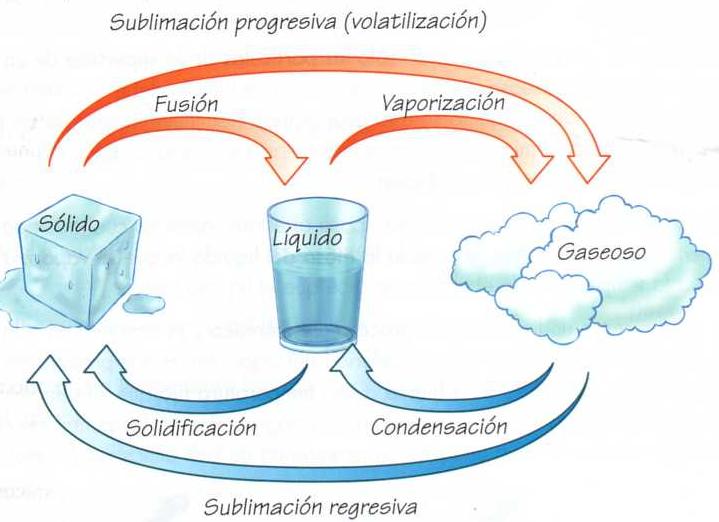
temperatura:



formulas para convertir la temperatura
presión:
 :
:
La presión (símbolo p) es una magnitud física que mide la proyección de la fuerza en dirección perpendicular por unidad de superficie , y sirve para caracterizar cómo se aplica una determinada fuerza resultante sobre una línea.La presión de cierto vapor o gas puede provocar la ruptura de algún reactor, asi como también en algún instrumento de medición puede arrojar datos relevantes de cualquier estudio. La presión es básicamente usada para determinar procesos en los que la temperatura juega un papel fundamental en la realización de algún experimento con una reacción química.
La presión de un gas se observa mediante la medición de la presión externa que debe ser aplicada a fin de mantener un gas sin expansión ni contracción.
formula:
volumen:

Es la cantidad de espacio que ocupa un cuerpo. El volumen es una magnitud física derivada. La unidad para medir volúmenes en el Sistema Internacional es el metro cúbico (m3) que corresponde al espacio que hay en el interior de un cubo de 1 m de lado. Sin embargo, se utilizan más sus submúltiplos, el decímetro cúbico (dm3) y el centímetro cúbico (cm3). Sus equivalencias con el metro cúbico son: 1 m3 = 1 000 000 cm3 En química general el dispositivo de uso más frecuente para medir volúmenes es la probeta. Cuando se necesita más exactitud se usan pipetas o buretas. Las probetas son recipientes de vidrio graduados que sirven para medir el volumen de líquidos(leyendo la división correspondiente al nivel alcanzado por el líquido) y sólidos (midiendo el volumen del líquido desplazado por el sólido, es decir la diferencia entre el nivel alcanzado por el líquido solo y con el sólido sumergido) cantidad de gas: |


ley de los gases:
avogadro:


ley de boyle:


ley de charles:


ley de gay-lussac:


gases ideales:
La ley de los gases ideales es la ecuacion de estdo y el gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
donde k es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
- ecuación:
ley generalizada:

La ley combinada de los gases o ley general de los gases es una ley de los gaes que combina la ley de Bolyle, la ley de Charles y la ley de Gay-Iussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presion y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
puede formularse como:
donde:
- P es la presion
- V es el volumen
- T es la temperatura absoluta
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
Otra forma de expresarlo es la siguiente:
PANTALLASOS LABORATORIO :













EJERCICIOS:
Pulsa el link para ver el archivo adjunto en word de los ejercicios
https://drive.google.com/file/d/0Bx5d-U6rG6nqQjdyOEdFbFdqdlE/view?usp=sharing
LABORATORIO DE BALANCEO

"Balanceo de ecuaciones",en clase de química realizamos una actividad online donde a partir de una serie de ecuaciones que el programa nos da teníamos que ubicar los correspondientes valores en cada compuesto para lograr balancear la ecuación y así mismo superar los objetivos de la actividad,el objetivo de este programa es que aprendamos rápidamente el funcionamiento de la herramienta y alcanzar los distintos níveles,donde cada uno consta de cinco ejercicios) a lazar . Es una forma de aprendizaje significativo que nos permite adquirir práctica y agilidad en este campo mediante un método interactivo, rápido y sencillo.
OBJETIVOS:
- Reconocer los compuestos de la ecuación
- facilitar el conocimiento de los números de oxidación que se encuentra trabajando con cada elemento
- Aplicar el método de oxido-reducción cuando es necesario.
MARCO TEÓRICO:
- Reacción y Ecuación química: Una reacción química es un proceso en el que una sustancia cambia para formar una o más sustancias nuevas.

La ley de la conservación de la materia afirma que ningún átomo puede crearse o destruirse en una reacción química, así que el número de átomos que están presentes en los reactivos tiene que ser igual al número de átomos presentes en los productos.
Cada sustancia se representa por su fórmula química, y posteriormente debemos ajustar (equilibrar ó balancear) toda la ecuación. Para ello existen diversos métodos, en esta unidad veremos dos de ellos:
MÉTODO DE OXIDO-REDUCCIÓN O REDOX:
El mecanismo de igualación es el siguiente:
1. Se determina el número de oxidación para cada uno de los elementos de la reacción.
2. Se establecen cuales átomos se oxidan y cuales se reducen.
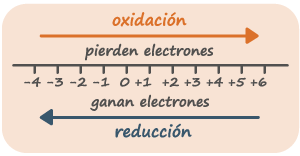
3. Se calcula el número de oxidación de cada uno de estos átomos tanto en su forma oxidada como reducida y se procede a escribir ecuaciones iónicas.
4. Se sinplifican los coeficientes del oxidante y reductor de tal froma que el número total de electrones ganados y pérdidos sea el mismo; para ello multiplicamos en las ecuaciones iónicas el número de electrones por factores adecuados.
5. Se asignan como coeficientes de las sustancias afectadas en la ecuación los factores que se utilizaron para que el número de electrones sea igual.
6. Por ultimo, el equilibrio se logra por el método de ensayo y error.

- El Hidrogeno cuenta con +1 excepto los hidruros donde trabaja con -1
- Determinar los diferentes numeros de oxidacion que hay en la ecuacion
MÉTODO POR TANTEO:
En este método probamos diferentes coeficientes para igualar el número de átomos de cada elemento en ambos lados de la ecuación.
1. Se verifica si la ecuación química está balanceada; esto lo conseguimos contando la cantidad de átomos que tenemos de los elementos reactivos y comparándola con la cantidad que tenemos de producto.
1.1 Primero se balancea los elementos Metálicos.Buscamos los coeficientes que nos den la misma cantidad de reactivos que de productos en los elementos metálicos,despues los no metalicos,posteriormente los hidrógenos y por ultimo los oxígenos.
PRÁCTICA ONLINE
2.
Combust Methane:
JUEGO:
- NIVEL 1
La Tiza Virtual
SALES BINARIAS Y OXOSALES

En este espacio trabajaremos lo que es la nomenclatura y formulación de sales binarias y oxosales, para ello utilizaremos como simulador la aplicación online de "La Tiza Virtual".
OBJETIVOS:
- Reconocer la fórmula de los compuestos
- Tener un conocimiento mas profundo acerca del tema
- Diferenciar entre sales binarias y oxosales
MARCO TEÓRICO:
SALES BINARIAS:
Las sales binarias, también conocidas como sales neutras, son el resultado de la combinación entre un metal y un no metal. De acuerdo a la fórmula de esta combinación de tipo binario, primero se debe escribir el símbolo del metal junto a su valencia y luego el símbolo del no metal con su valencia correspondiente.
Cabe destacar, por otro parte, que el no metal de las sales binarias siempre emplea su menor valencia.
Nomenclatura:
- Tradicional
Se pone primero el nombre del no metal, seguido de la palabra uro. A continuación se coloca el nombre del metal terminado en ico. Si el metal tiene dos valencias se emplea la terminación "oso" para la menor e "ico" para la mayor. Ejemplos:
FeCl3-------------------------------------Cloruro Férrico.
CaBr2-----------------------------------Bromuro Cálcico.
- Sistemática:
El proceso es muy sencillo. En concreto, lo que hay que hacer es comenzar poniendo el nombre del no metal acabado con la terminación -uro, pero se proceden a añadir dos prefijos. Estos vienen a indicar lo que es el número de átomos del metal y del no metal. Ejemplos:
FeCl3-------------------------------------TrIcloruro de Hierro.
Co2S3------------------------------------Trisulfuro de dicobalto.
- Stock:
Es la más utilizada para nombrar estos compuestos. Se nombra de manera similar a la tradicional: se escribe primero el nombre del no metal terminado en uro y después la preposición de y por último el nombre del metal, indicando su valencia en números romanos y entre paréntesis. Ejemplos:
FeCl3-------------------------------------Cloruro de Hierro (III).
CaBr2-------------------------------------Bromuro de calcio (II).
Además de todo lo expuesto hasta el momento acerca de las sales binarias, es importante que conozcamos que existen varios tipos de ellas. Así, por ejemplo, nos encontramos con las halógenas, las mixtas, las ácidas, las básicas, las sales binarias halógenas neutras….
OXOSALES:
Una sal ox(o)ácida, oxosal u oxisal es el producto de sustituir alguno, o todos, los hidrógenos de un oxácido por cationes metálicos, por ejemplo K+, o no metálicos, por ejemplo NH4+. Cuando se sustituyen todos los hidrógenos se forma una oxosal neutra y cuando solo se sustituye una parte una sal ácida
Características:
- Las sales son compuestos que forman agua oxigenada.
- Las sales típicas tienen un punto de fusión alto, baja dureza, y baja comprensibilidad.
Formación:
Es el resultado de la combinación de un hidróxido con un ácido oxácido.
La forma más simple de formar una oxosal es generando el oxoanión a partir del oxiácido correspondiente, de la siguiente forma: El anión resulta por eliminación de los hidrógenos existentes en la fórmula del ácido. Se asigna una carga eléctrica negativa igual al número de hidrógenos retirados, y que, además, será la valencia con que el anión actuará en sus combinaciones.
Los aniones se nombran utilizando las reglas análogas que las sales que originan. Ejemplos:
Unión de un hidróxido con un ácido oxácido:
| Fórmula | Nomenclatura sistemática | Nomenclatura Stock |
|---|---|---|
| Mn(OH)2 + H2SO3 → MnSO3+2H2O | ||
| Co(OH)+2 + H2SiO3-2 → CoSiO3+H2O | Silicato de cobalto II |
Unión de un metal con un radical:

SEGUNDO PERIODO
laboratorio virtual
MATERIALES DEL LABORATORIO:En esta presentación de blog podrás encontrar la descripción y utilidad de materiales utilizados en el laboratorio. Se encuentran herramientas para: medir volúmenes, diferentes tipos de matraces, material en general, material para pesar, material para calentar, refrigerantes, soportes, embudos, instrumentos, material de seguridad,ETC.
objetivos:
- Conocer los materiales utilizados en un laboratorio.
- Determinar el material por el cual fueron realizados
- Conocer la función de cada uno de las herramientas o materiales.
- Conocer a que tipo de materiales de laboratorio pertenece.
- Determinar el grado importancia de cada uno de estos
PROBETA
MATERIAL:Vidrio
PARA QUE SIRVE: permite contener líquidos y sirve para medir volúmenes de forma aproximada.

PIPETA GRADUADA
MATERIAL:Vidrio
PARA QUE SIRVE:Pipetas para las cuales la capacidad correspondiente a cualquier línea de graduación se define como el volumen de agua,expresado en mililitros, vertido por la pipeta, permitir el drenaje del líquido adherido a las paredes antes del enrase final.
PIPETA AFORADA
MATERIAL:Vidrio
PARA QUE SIRVE:Esta hecha para entregar un volumen bien determinado, el que esta dado por una o dos marcas en la pipeta.
BURETA
MATERIAL:Vidrio
PARA QUE SIRVE:se utiliza para emitir cantidades variables de líquido con gran exactitud y precisión.

MATRAZ AFORADO
MATERIAL:Vidrio
PARA QUE SIRVE:posee un cuello alargado y estrecho, con un aforo que marca dónde se debe efectuar el enrase, el cual nos indica un volumen con gran exactitud y precisión.

MATRAZ ERLENMEYER
MATERIAL:Vidrio
PARA QUE SIRVE:Se utiliza para calentar líquidos cuando hay peligro de pérdida por evaporación.

MATRAZ DE FONDO REDONDO
MATERIAL:Vidrio
PARA QUE SIRVE:se utiliza para realizar reacciones inclusive en caliente. Su fondo esférico favorece la concentración de los reactivos, no se puede apoyar en una superficie plana, por lo que se utiliza un soporte.

MATRAZ DE FONDO PLANO
MATERIAL:Vidrio
PARA QUE SIRVE:Se utiliza para realizar reacciones inclusive en caliente.

MATRAZ DE DOS BOCAS
MATERIAL:Vidrio
PARA QUE SIRVE:una boca(la superior)sirve para verter las sustancias y el lateral es para conectar conectar un filtrador.
MATRAZ CORAZON
MATERIAL:Vidrio
PARA QUE SIRVE:
MATRAZ DE DETILACION
MATERIAL:Vidrio
PARA QUE SIRVE:Está diseñado para calentamiento uniforme, y se produce con distintos grosores de vidrio para diferentes usos.

MATRAZ KITASATO
MATERIAL:
PARA QUE SIRVE:sirve para realizar experimentos con peluche, como destilación, recolección de gases hidroneumática (desplazamiento de volúmenes), filtraciones al vacío, etc.
VASO DE PRECIPITADOS
MATERIAL:
PARA QUE SIRVE:se utiliza sobre todo, para preparar o calentar sustancias y traspasar líquidos.

VARILLA DE AGITACION
MATERIAL:Vidrio
PARA QUE SIRVE:se utiliza para agitar las disoluciones con varillas huecas, mediante su calentamiento con el mechero y posterior estiramiento, se consiguen capilares.
TUBO DE ENSAYO
MATERIAL:Vidrio
PARA QUE SIRVE:se utiliza en los laboratorios para contener pequeñas muestras líquidas o solidas, aunque pueden tener otras fases, como realizar reacciones químicas en pequeña escala, Entre ellos esta el exponer a temperatura el mismo contenedor. Se guardan en un instrumento.

FRASCO LAVADOR
MATERIAL: Plástico o vidrio
PARA QUE SIRVE:para contener algún solvente, por lo general agua destilada o desmoralizadora, aunque también solventes orgánicos.
CRISTALIZADOR
MATERIAL:Vidrio
PATRA QUE SIRVE:Su objetivo principal es cristalizar el soluto de una solucion, por evaporación del solvente.

CUENTA GOTAS
MATERIAL:Goma
PARA QUE SIRVE:Se utiliza para trasvasar pequeñas cantidades de líquido vertiéndolo gota a gota.

PIPETA PASTEUR
MATERIAL: Plastico blando.
PARA QUE SIRVE:Es ideal para poder extraer líquidos para realizar mezclas o diluir concentrados en agua.

MORTERO
MATERIAL:Madera,metal,cerámica y piedra.
PARA QUE SIRVE:se utiliza para machacar distintas sustancias, y todavía presente en la cocina tradicional para majar alimentos.

BALANZA
MATERIAL:
PARA QUE SIRVE:instrumento que sirve para medir masa y peso.

GRANATARIO
MATERIAL:
PARA QUE SIRVE:es un tipo de balanza utilizada para determinar o pesar la masa de objetos y gases.
CUCHARITA-ESPATULA
MATERIAL:Metal
PARA QUE SIRVE: Se utiliza para tomar pequeñas cantidades de compuestos que son, básicamente, polvo.

VIDRIO DE RELOJ
MATERIAL:Vidrio
PARA QUE SIRVE: Se utiliza en química para evaporar líquidos, pesar productos sólidos o como cubierta de vasos de precipitados, y contener sustancias parcialmente corrosivas.

PLACA PETRI
MATERIAL:Cristal o plástico.
PARA QUE SIRVE:con una cubierta de la misma forma que la placa, pero algo más grande de diámetro, para que se pueda colocar encima y cerrar el recipiente, aunque no de forma hermética.

PESASUSTANCIAS
MATERIAL:
PARA QUE SIRVE:Instrumentos en los cuales se colocan las sustancias que desean pesarse.

ESPATULA
MATERIAL:Metal
PARA QUE SIRVE:Se utiliza para tomar pequeñas cantidades de compuestos que son, básicamente, polvo.
MECHERO BUNSEN
MATERIAL:
PARA QUE SIRVE:es un instrumento utilizado en laboratorios científicos para calentar o esterilizar muestras o reactivos químicos.

MECHERO DE ALCOHOL
MATERIAL:
PARA QUE SIRVE:Se utiliza en laboratorio para hacer combustión.

PINZAS DE CRISOL
MATERIAL:Metal
PARA QUE SIRVE:tijeras grandes con el extremo adaptado para sujetar un crisol mientras se calienta fuertemente.
CRISOL
MATERIAL:Arcilla
PARA QUE SIRVE:es una cavidad en los hornos que recibe el metal fundido.

REJILLA DE AMIANTO
MATERIAL:Metal
PARA QUE SIRVE: La rejilla de amianto se coloca entre el fuego y el recipiente a calentar para que no entren en contacto directo e impida que se rompan debido a diferencias bruscas de temperatura.
PINZA PARA TUBO DE ENSAYO
MATERIAL:Metal
PARA QUE SIRVE:se pueden sujetar diferentes objetos de vidrio o realizar montajes más elaborados (aparato de destilación).
CAPSULA DE PORCELANA
MATERIAL:Porcelana.
PARA QUE SIRVE:Es un vaso químico de fondo redondo para concentrar soluciones.

REFRIGERANTE RECTO
MATERIAL:Vidrio
PARA QUE SIRVE:Se usa para condensar los vapores que se desprenden del matraz de destilacion, por medio de un liquido refrigerante que circula por éste, usualmente agua.
REFRIGERANTE DE BOLA
MATERIAL:Vidrio
PARA QUE SIRVE: su función es presentar mayor superficie de contacto entre el vapor de su interior caliente y el agua exterior que enfría. De este modo se asegura que todo el vapor se condense en líquido.
REFRIGERANTE DE SERPENTIN
MATERIAL:Vidrio o cobre.
PARA QUE SIRVE:para enfriar vapores provenientes de la detilacion en un calderín y así condensarlos en forma liquida.
TRIPODE
MATERIAL:
PARA QUE SIRVE:se utiliza cuando no se tiene el soporte universal para sostener objetos con firmeza.

PIE
MATERIAL:
PARA QUE SIRVE:Para sostener elementos del laboratorio.

ARO
MATERIAL:
PARA QUE SIRVE:Sostener elementos.
GRADILLA PARA TUBOS DE ENSAYO
MATERIAL:
PARA QUE SIRVE: Sostener tubos de ensayo.

EMBUDOS (PLANO-DE FILTRACION-BUCHNER)
MATERIAL:Su diseño ha sido modificado para adaptarse a la funcionalidad concreta que desempeñan.
PARA QUE SIRVEN:son embudos que forman parte del equipamiento de laboratorio químico.
TAPONES
MATERIAL:Caucho
PARA QUE SIRVEN:es una herramienta utilizada para sellar un contenedor.

TERMOMETRO
MATERIAL:Vidrio
PARA QUE SIRVE:medir temperaturas con escalas en grados centigrados o Fahrenheit.

TERMOMETRO DIGITAL
MATERIAL:
PARA QUE SIRVE:tienen un sensor externo y tiene hasta la posibilidad de sumergirse en agua.

PICNOMETRO
MATERIAL:Vidrio
PARA QUE SIRVE: puede obtenerse un volumen con gran precisión. Esto permite medir la densidad de un fluido.

PH METRO
MATERIAL:Vidrio y otros.
PARA QUE SIRVE:Es un sensor utilizado en el método electroquimico, para medir el pH de una disolución.

CONDUCTIMETRO
MATERIAL:
PARA QUE SIRVE: mide la resistencia eléctrica que ejerce el volumen de una disolución encerado entre los dos electrodos.

MUFLA
MATERIAL:Electroquimico
PARA QUE SIRVE:Es una especie de horno con el cual se alcanzan muy elevadas temperaturas.

MATERIALES DE SEGURIDAD
PARA QUE SIRVEN:Para protegerse de las reacciones químicas.
GAFAS DE SEGURIDAD

GUANTES

LAVAOJOS
EXTINTOR

conclusiones
Esta parte del blog te ayudara a incrementar tu conocimiento en este tema de las herramientas,instrumentos y materiales que son utilizados en los laboratorios de química;así mismo para que tengas precauciones con los riesgos que pueden causar estos.
OBJETIVOS:
1-El objetivo principal de esta practica es resolver las dudas.
2-Mejorar las dificultades que hay en el tema.
taller de nomenclaturas
En este taller practique las nomenclaturas de diferentes óxidos y así mismo profundice mi conocimientos en el tema.Nomenclatura sistemática y stock con óxidos y nomenclatura sistemática y stock con hidróxidos.
OBJETIVOS:
1-El objetivo principal de esta practica es resolver las dudas.
2-Mejorar las dificultades que hay en el tema.
PANTALLASOS PRACTICA CON HIDROXIDOS
Con esta practica pudimos practicar las nomenclaturas sistemática y stock,corrigiendo errores y aclarando dudas,así mismo profundizando el tema.
LABORATORIO VIRTUAL
primer paso elementos de seguridad
tercer paso escoger los materiales de trabajo
cuarto paso preparación de la solución
quinto paso preparación del experimento
sexto paso obtención de óxidos (vista molecular y vista macroscopica)
séptimo paso verificación (ph de los elementos) color naranja
octavo paso contrastacion de sustancias(tipo de sustancia ,color,entre otros)
noveno y decimo paso conclusiones y limpieza
En esta practica experimente con elementos metales y no metales,hice el paso a paso de mezclar las diferentes sustancias para llegar a resultados como (el ph,color,tipo de sustancia,entre otros) me gusto esta practica ya que es virtual y no corres ningún riesgo de que te lastimes con alguna reacción química,la recomiendo para que hagas uso de ella y profundices tus conocimientos.
PANTALLASOS YENKA
NIVELACIÓN SEGUNDO PERIODO
LINK TRABAJO DE PAREJAS MODULO:
https://drive.google.com/file/d/0Bx5d-U6rG6nqdzR5NGJOdlZacnc/view?usp=sharing
LINK VIDEO QUIMICA:
primer periodo
FORMULA:
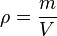
Pantallasos procedimiento con la madera
MADERA-1
MADERA-2
Procedimientos para hallar la densidad en la madera (madera-1 y madera-2)
Pantallasos procedimiento con el ladrillo
LADRILLO-1
LADRILLO-2
Procedimientos para hallar la densidad en el ladrillo (ladrillo-1 y ladrillo-2)
Pantallasos procedimiento con el aluminio
ALUMINIO-1
ALUMINIO-2
Procedimientos para hallar la densidad con el aluminio (aluminio 1 y aluminio 2)
Procedimientos para hallar la densidad con el hielo




































































